过氧化钙()是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在溶液中加入;
②不断搅拌的同时加入30% ,反应生成沉淀;
③经过陈化、过滤,水洗得到,再脱水干燥得到。
完成下列填空
2.第①步反应的化学方程式为。第②步反应的化学方程式为。
3.可循环使用的物质是。
工业上常采用过量而不是过量的方式来生产,这是因为。
4.检验是否洗净的方法是。
5.加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是、。
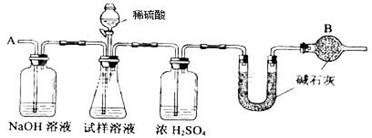
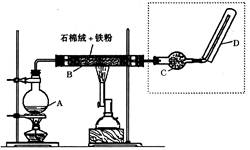
6.已知在350迅速分解生成和。下图是实验室测定产品中含量的装置(夹持装置省略)。

若所取产品质量是,测得气体体积为(已换算成标准状况),则产品中的质量分数为(用字母表示)。
过氧化钙的含量也可用重量法测定,需要测定的物理量有。
 璃仪器有:。
璃仪器有:。 。
。
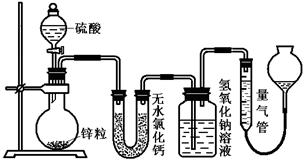
 H2)/n(SO2)=_______________(用含字母的代数式表示)。
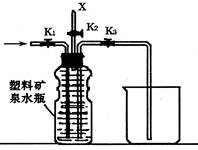
H2)/n(SO2)=_______________(用含字母的代数式表示)。 地测量气体体积,量气管在读数时应注意:、、。
地测量气体体积,量气管在读数时应注意:、、。 粤公网安备 44130202000953号
粤公网安备 44130202000953号