硫代硫酸钠俗称“海波”,又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图(a)所示。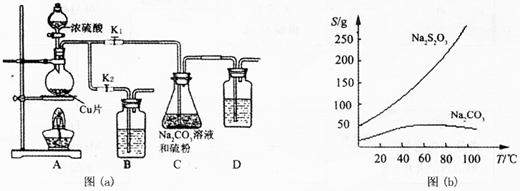
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是 .
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的 (填编号)。
A.NaOH溶液 B.浓H2SO4
C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH 时,打开K2、关闭K1并停止加热;C中溶液要控制pH的原因是 。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液 、过滤、 、烘干,得到产品。
(2)Na2S2O3性质的检验:
向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 ,
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时CrO24全部转化为Cr2O2-7;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18. 00 mL。部分反应的离子方程式为:
Cr2O72-+6I-+14H+=3I2+2Cr3++3I2+7H2O
I2+2S2O32-=S4O62-+2I-
则该废水中Ba2+的物质的量浓度为 。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.3
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
 在盛放浓硫酸的试剂瓶的标签上印有如图所示的警示标志,说明浓硫酸是一种 。
在盛放浓硫酸的试剂瓶的标签上印有如图所示的警示标志,说明浓硫酸是一种 。
 学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O)
学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O)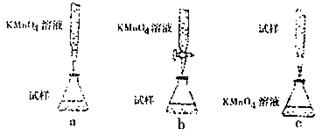
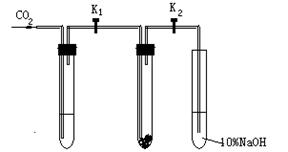


 混合液的颜色逐渐变黑,请用简要文字和化学方程式说明原因__________________________________________________________________。
混合液的颜色逐渐变黑,请用简要文字和化学方程式说明原因__________________________________________________________________。