(14分)氨是重要的化工原料,可以制尿素等多种产品
(1)合成氨所用的氢气可以甲烷为原料制得,有关化学反应的能量变化如下图所示。
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合亚铜溶液来吸收原料氕中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l)
[Cu(NH3)3]CH3COO·CO(l) 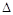 H<0,吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 (填写选项编号)。
H<0,吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 (填写选项编号)。
A.高温、高压 B.高温、低压
C.低温、低压 D.低温、高压
(3)氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0,某温度下,向容器为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。该温度下次反应的平衡常数K为 。
CO(NH2)2(l)+H2O(g) △H<0,某温度下,向容器为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。该温度下次反应的平衡常数K为 。
(4)取两个相同的恒容容器,保持相同温度,并加入等量的CO2气体,根据实验数据绘制出(NH3)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则____(填“A”或“B”)曲线所对应的实验温度高,判断的依据是 。
(5)已知某些弱电解质在水中的电离平衡常数(25 ℃)如下表:
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+ )>c(CO32-)>c(HCO3- )>c(NH3·H2O)
B.c(NH4+ )+c(H+)=c(HCO3- )>c(OH-)+ c(CO32-)
C.c(HCO3- )+c(H2CO3)+ c(CO32-)="0.1" mol·L-1
D.c(NH4+ )+c(NH3·H2O)=2c(CO32-)>2c(HCO3- )+ 2c(H2CO3)
 CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号