铬元素及其化合物在生产、生活中具有广泛的用途。
(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。其金属性比铜 (填“强”或“弱”)。
(2)Cr(OH)3和Al(OH)3性质类似,则Cr(OH)3与KOH反应的离子方程式为 。
(3)工业上净化处理铬污染的可用电解法。将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe作阳极和石墨作阴极进行电解。经过一段时间后,溶液中Cr和Fe转化为Cr(OH)3和Fe(OH)3沉淀除去。
①写出阴极的电极反应式: 。
②溶液中Fe、Cr元素最终转化为Fe(OH)3和Cr(OH)3沉淀除去,原理为 (用离子方程式和必要的文字说明)。
③电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为 mol·L-1
(已知Ksp[ Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×l0-31)。
(4)CrO3具有强氧化性,可用于查处酒驾,原理是在酸性条件下能将乙醇氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],则该反应的化学方程式为 。
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率( )随温度的变化如图所示,则B点时剩余固体的成分是____________(填化学式)。
)随温度的变化如图所示,则B点时剩余固体的成分是____________(填化学式)。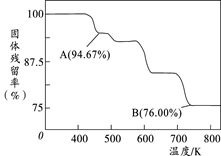
 为止,半分钟后不恢复红色,记下读数V2 mL。
为止,半分钟后不恢复红色,记下读数V2 mL。 2)观察滴定管里液面的高度时应注意:。
2)观察滴定管里液面的高度时应注意:。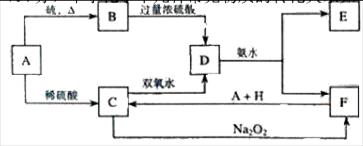
 E、F、H的化学式:AB __
E、F、H的化学式:AB __ _________、D ___________、E。
_________、D ___________、E。 。
。 (2)过滤,滤出不溶物有铜,则滤液中肯定有的阳离子,肯定不存在的阳离子,可能有的阳离子
(2)过滤,滤出不溶物有铜,则滤液中肯定有的阳离子,肯定不存在的阳离子,可能有的阳离子 ,可选用试剂
,可选用试剂 )除去Fe粉中混有的少量铝粉,可选用试剂
)除去Fe粉中混有的少量铝粉,可选用试剂 粤公网安备 44130202000953号
粤公网安备 44130202000953号