研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________。
利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移0.4mol电子时,消耗的NO2在标准状况下的体积是______L。
7N2+12H2O也可处理NO2。当转移0.4mol电子时,消耗的NO2在标准状况下的体积是______L。
(2)SO2可用足量的NaOH溶液吸收,该反应的离子方程式为______;若继续通入SO2,当n (SO2): n(NaOH)=1:1时所得溶液呈酸性,下列关系正确的是_____ (填字母编号)。
a. c(Na+)> c(HSO3-)> c(SO32-)
b. c(Na+)+ c(H+)= c(SO32-)+ c(HSO3-)+ c(OH-)
c. c(Na+)= c(SO32-)+ c(HSO3-)
SO2也可用O2氧化生成SO3
已知:①NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH =" -41.8" kJ/mol ;
SO3(g)+NO(g) ΔH =" -41.8" kJ/mol ;
②2NO(g)+O2(g)  2NO2(g) ΔH =" -113.0" kJ/mol ;
2NO2(g) ΔH =" -113.0" kJ/mol ;
则反应2SO2(g)+O2(g)  2SO3(g) ΔH=______ kJ/mol。
2SO3(g) ΔH=______ kJ/mol。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。
①该反应ΔH______0(填“>”或“<”)。
②若容器容积不变,下列措施可提高CO转化率的是_____。
a.升高温度 b.将CH3OH(g)从体系中分离
c.充入氦气,使体系总压强增大 d.再充入一定量的 CO气体
 CO2(g)+2H2O(g)
CO2(g)+2H2O(g)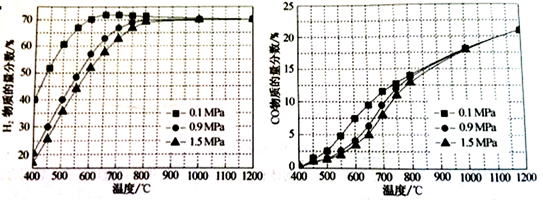
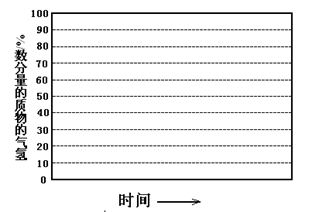
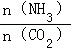 =4时,CO2的转化率随时间的变化关系如图1所示.
=4时,CO2的转化率随时间的变化关系如图1所示.
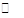 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下: AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。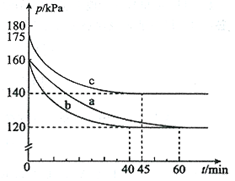
 粤公网安备 44130202000953号
粤公网安备 44130202000953号