以下是反应:2SO2+O2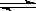 2SO3在不同条件下达到平衡状态时SO2的转化率。
2SO3在不同条件下达到平衡状态时SO2的转化率。
试回答下列问题。
(1)关于可逆反应的限度,你能得出什么启示?______________________________。
(2)提高该化学反应限度的途径有:_____________________________________________。
(3)要实现SO2的转化率为93.5%,需控制的反应条件是_______________________________________。
以下是反应:2SO2+O2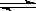 2SO3在不同条件下达到平衡状态时SO2的转化率。
2SO3在不同条件下达到平衡状态时SO2的转化率。
试回答下列问题。
(1)关于可逆反应的限度,你能得出什么启示?______________________________。
(2)提高该化学反应限度的途径有:_____________________________________________。
(3)要实现SO2的转化率为93.5%,需控制的反应条件是_______________________________________。