某城市自来水的处理过程如图所示: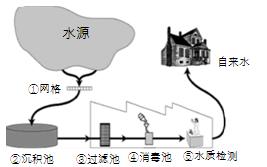
(1)步骤①网格净水原理类似于步骤______(选填图中②~⑤的序号)。
(2)步骤②所起的作用是______(填序号)。
| A.杀死水中的细菌 | B.减少水中氧气 |
| C.使泥沙沉积至底部 | D.分解有毒物质 |
(3)步骤④中的消毒剂除氯气以外,还可用一氯胺(NH2Cl)、二氧化氯等物质。二氧化氯中氧、氯两种元素的质量比是______(结果以最简整数比表示)。
某城市自来水的处理过程如图所示:
(1)步骤①网格净水原理类似于步骤______(选填图中②~⑤的序号)。
(2)步骤②所起的作用是______(填序号)。
| A.杀死水中的细菌 | B.减少水中氧气 |
| C.使泥沙沉积至底部 | D.分解有毒物质 |
(3)步骤④中的消毒剂除氯气以外,还可用一氯胺(NH2Cl)、二氧化氯等物质。二氧化氯中氧、氯两种元素的质量比是______(结果以最简整数比表示)。