甲、乙两种固体(无结晶水)的溶解度曲线如图。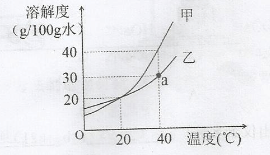
①图中a点的含义是( 11 ) ;
②40℃时,50g水中最多溶解( 12 ) g甲;
③正确的说法是( 13 )
| A.20℃时,甲、乙溶液所含溶质质量相等 |
| B.40℃时,将10%的甲溶液降温至20℃,其溶质质量分数减小 |
| C.40℃时,分别向100g水中加入35g甲、乙,所得溶液的溶质质量分数:甲>乙 |
| D.40℃时,甲、乙两杯饱和溶液所含溶质质量相同,则溶液质量的大小关系:甲<乙 |
甲、乙两种固体(无结晶水)的溶解度曲线如图。
①图中a点的含义是( 11 ) ;
②40℃时,50g水中最多溶解( 12 ) g甲;
③正确的说法是( 13 )
| A.20℃时,甲、乙溶液所含溶质质量相等 |
| B.40℃时,将10%的甲溶液降温至20℃,其溶质质量分数减小 |
| C.40℃时,分别向100g水中加入35g甲、乙,所得溶液的溶质质量分数:甲>乙 |
| D.40℃时,甲、乙两杯饱和溶液所含溶质质量相同,则溶液质量的大小关系:甲<乙 |