[化学——选修2化学与技术]氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
|
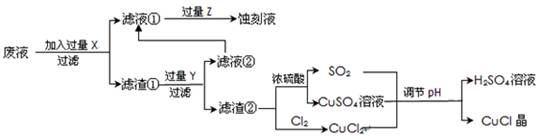
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是_____,现代氯碱工业的装置名称是_____________________。
(2)写出生产过程中X__________Y__________(填化学式)。
(3)写出产生CuCl的化学方程式________________________________。
(4)生产中为了提高CuCl产品的质量,采用______________法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是_______________;生产过程中调节溶液的pH不能过大的原因是_____________。
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是______。
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_______。
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 =CuCl2 + FeCl2 Fe2+ + Ce4+=Fe3+ + Ce3+ 如此再重复二次测得:
| |
1 |
2 |
3 |
| 空白实验消耗硫酸铈标准溶液的体积(ml) |
0.75 |
0.50 |
0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) |
24.65 |
24.75 |
24.70 |
④数据处理:计算得该工业CuCl的纯度为_________(平行实验结果相差不能超过0.3%)

 粤公网安备 44130202000953号
粤公网安备 44130202000953号