甲、乙组同学分别做了以下探究实验。
(1)甲组探究Cl2与Na2SO3溶液反应,实验装置如下。

①请指出该装置的不足之处 、 。
②Cl2与Na2SO3溶液反应的离子方程式为 。
③设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化 。
乙组探究乙酸乙酯(沸点77.1℃)在不同温度、不同浓度NaOH溶液中的水解速率。
取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率。
| 实验 试剂 |
试管Ⅰ(55℃) |
试管Ⅱ(55℃) |
试管Ⅲ(55℃) |
试管Ⅳ(75℃) |
| 乙酸乙酯/mL |
1 |
V1 |
V2 |
V2 |
| 1mol·L—1NaOH/mL |
V4 |
3 |
0 |
V5 |
| 蒸馏水/mL |
0 |
V6 |
5 |
2 |
④请完成上表,其中V2 = ,V4= ,V5= 。
⑤实验中,可用饱和食盐水替代蒸馏水,其优点是 ;但不能用饱和Na2CO3溶液替代蒸馏水,其原因是 。
⑥实验中,试管Ⅳ比试管Ⅱ中的酯层减少更快,其原因有:温度高速率快,还可能有 。

 查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。 进一步探究:
进一步探究:
 ② IBr+KI=I2+KBr ③ I2+2S2O32-=2I-+S4O62-
② IBr+KI=I2+KBr ③ I2+2S2O32-=2I-+S4O62- 请
请

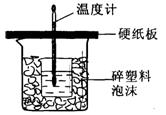

 内装的是 ,其作用是 。
内装的是 ,其作用是 。 粤公网安备 44130202000953号
粤公网安备 44130202000953号