【改编】氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
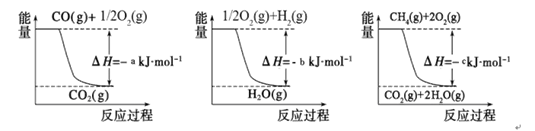
①用焦炭跟水反应:C(s)+ H2O(g) CO(g)+ H2(g);
CO(g)+ H2(g);
②用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH=_____________。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
3 |
|
| N2的体积分数 |
ω1 |
ω2 |
ω3 |
| 混合气体密度(g·L-1) |
ρ1 |
ρ2 |
|
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4)分析上表数据,下列关系正确的是________。
a.2c1=3mol/L b.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=____ __(用分数表示)(mol/L)-2。
 。该物质中几种元素的第一电离能由大到小的顺序是 ,该物质的晶体中肯定不存在的作用力是 。
。该物质中几种元素的第一电离能由大到小的顺序是 ,该物质的晶体中肯定不存在的作用力是 。 = (填数字)。已知Kr晶体的密度为ρg/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a = nm。
= (填数字)。已知Kr晶体的密度为ρg/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a = nm。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号