(15分)工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的热值为142.9kJ·g-1
N2(g) + 2O2(g) = 2NO2(g) △H=+133kJ·mol-1
H2O(g) =H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为 。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a.混合气体的平均式量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1mol CO2生成的同时有3mol H-H键断裂
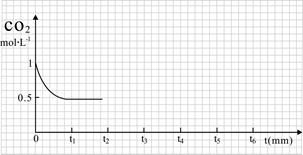
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。
(2)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
| |
反应时间 |
CO2(mol) |
H2(mol) |
CH3OH(mol) |
H2O(mol) |
| 反应I恒温恒容 |
0 min |
2 |
6[ |
0 |
0 |
| 10min |
|
4.5 |
|
|
|
| 20min |
1 |
|
|
|
|
| 30min |
|
|
1 |
|
|
| 反应II 绝热恒容 |
0 min |
0 |
0 |
2 |
2 |
①达到平衡时,反应I、II对比:平衡常数K(I) K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II)。
②对反应I,前10min内的平均反应速率v(CH3OH)= ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1 T2(填“>”、“<”或“=”)。
若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”、“逆向”或“不”)。
 CHCOOH。试写出它与下列物质反应的方程式。
CHCOOH。试写出它与下列物质反应的方程式。 2SO3(g)当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g)当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号