Ⅰ.硝基苯甲酸乙酯在OH — 存在下发生水解反应:
O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示,回答下列问题:
| t/s |
0 |
120 |
180 |
240 |
330 |
530 |
600 |
700 |
800 |
| a/% |
0 |
33.0 |
41.8 |
48.8 |
58.0 |
69.0 |
70.4 |
71.0 |
71.0 |
(1)计算该反应在180~240s区间的平均反应速率 。
(2)为了提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施有: (要求写出两条)。
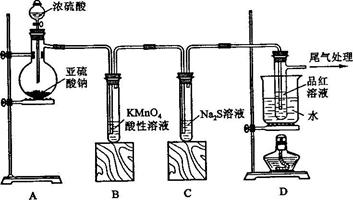
Ⅱ.某研究性学习小组利用下图所示装置进行实验。将CN-的浓度为0.2000 mol·L-1的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②锥形瓶中充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。

已知装置②中发生的主要反应依次为:
CN-+ClO-=CNO-+Cl-
2CNO-+2H++3C1O-=N2↑+2CO2↑+3C1-+H2O
(3)①和⑥中所装碱性物质的作用是 。
(4)装置③除去的物质是 ,一段时间后,CCl4层的颜色为 。装置②中,生成该物质的离子方程式为 。
(5)反应结束后,缓缓通入空气的目的是 。
(6)为计算该实验中含氰废水被处理的百分率,实验结束后要测定装置⑤的生成沉淀质量,经过滤、洗涤、反复烘干称量至恒重后测得沉淀质量为3.55g,则废水中CN-的转化率为 (保留三位有效数字)。
 (
),由此计算
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的
与
的量足以产生使
完全还原的氨气):
(
),由此计算
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的
与
的量足以产生使
完全还原的氨气):
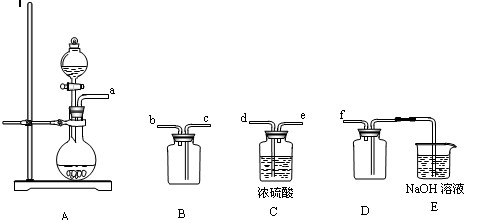
 的是 (填序号);
的是 (填序号); 干燥
干燥

 质的固体碘。
质的固体碘。

 应的化学方程式为;
应的化学方程式为; 溶液吸收。
溶液吸收。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号