某学校化学课外活动小组的同学用粗铜(含杂质铁)按如下流程回收氧化铜晶体(CuCl2·2H2O)等相关物质。请回答下列问题:

已知Cu2+、Fe3+沉淀时的相关PH:
| |
氢氧化物开始沉淀时的pH |
氢氧化物完全沉淀时的pH |
| Cu2+ |
4.7 |
6.7 |
| Fe3+ |
1.9 |
3.2 |
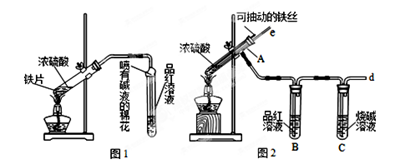
(1)为得到固体I.同学们设计下图装置:

①添加药品之前,如何检查装置A的气密性________________。
②整套装置有不足之处,要完成实验必须改进的是__________________。
③装置D的作用是__________________(用离子方程式表示)。
(2)操作Ⅱ和操作Ⅴ相同,其中所需的主要玻璃仪器有烧杯______、_______。
(3)试剂X用于调节pH以除去杂质。
①试剂X可以是_________(填字母序号)。
a.NaOH b.Cu(OH)2 c.Na2CO3 d.CuO
②为使CuCl2溶液中的Fe3+完全除去,溶液pH范围应保持在______,当溶液的pH=4时,c(Fe3+)=_____。[Fe(OH)3的KSP=4.0×10-38]
(4)由溶液Ⅳ欲获得氯化铜晶体(CuCl2•2H2O),应采取的措施是________。
(5)由溶液Ⅳ获得 CuCl2·2H2O晶体过程中,有同学发现溶液颜色由蓝色变为绿色进而变成黄绿色,经查阅资料发现氯化铜溶液中存在以下平衡关系:
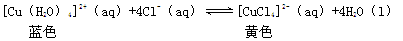
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中不能证明CuCl2溶液中有上述转化关系的是___(填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
 N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题:
N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题: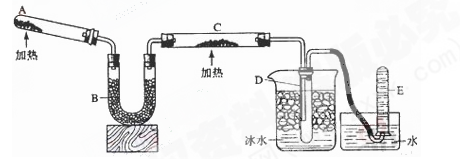
 粤公网安备 44130202000953号
粤公网安备 44130202000953号