下面A~F是几种常见烃的分子球棍模型。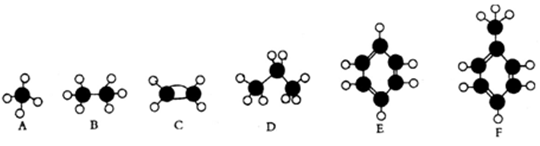
根据上述模型,回答下列问题:
(1)常温下含碳量最高的液态烃是 。
(2)能够发生加成反应的气态烃是 。
(3)一氯代物的同分异构体最多的是 。
(4)所有原子均在同一平面上的是 。
(5)能使酸性高锰酸钾溶液褪色的是 (填对应字母)。
下面A~F是几种常见烃的分子球棍模型。
根据上述模型,回答下列问题:
(1)常温下含碳量最高的液态烃是 。
(2)能够发生加成反应的气态烃是 。
(3)一氯代物的同分异构体最多的是 。
(4)所有原子均在同一平面上的是 。
(5)能使酸性高锰酸钾溶液褪色的是 (填对应字母)。