用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如下图: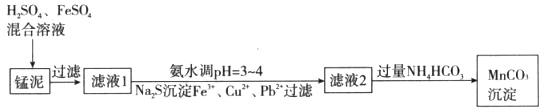
(1)锰泥中加入H2SO4、FeSO4混合溶液,反应的离子方程式是__________。
(2)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中c(H+)/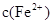 <0.7时,滤液1中能够检验出有Fe
<0.7时,滤液1中能够检验出有Fe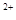 ;
;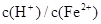 ≥0.7时,滤液1中不能检验出有Fe2+。
≥0.7时,滤液1中不能检验出有Fe2+。
①检验Fe2+是否氧化完全的实验操作是__________。
②生产时H2SO4、FeSO4混合溶液中c(H+)/c(Fe2+)控制在0.7~1之间,不宜过大,请从节约药品的角度分析,原因是__________。
若c(H+)/c(Fe2+)>1,调节c(H+)/c(Fe2+)到0.7~1的方法是__________。
(3)写出滤液2中加入过量NH4HCO3反应的离子方程式__________。
(4)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg(已知相对分子质量:MnO2 87;MnCO3 115)。

 NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是_______________。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐t。
NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是_______________。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐t。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号