如图A~H是初中化学常见的物质,其中B为紫红色固体单质,A、D均为无色气体,且D可参与光合作用,E为一种常见的钠盐,F为一种碱,H为蓝色沉淀。它们的转化关系如下图(其中部分反应物、生成物、反应条件已略去,箭头所指为生成物),请回答下列问题: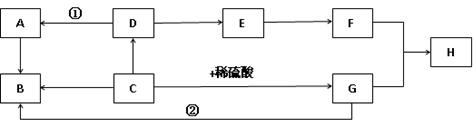
(1)反应①发生的条件是 ;(2)C的化学式是 ;
(3)反应②的化学方程式 ;
(4)图中的转化至少能发生 个复分解反应。
如图A~H是初中化学常见的物质,其中B为紫红色固体单质,A、D均为无色气体,且D可参与光合作用,E为一种常见的钠盐,F为一种碱,H为蓝色沉淀。它们的转化关系如下图(其中部分反应物、生成物、反应条件已略去,箭头所指为生成物),请回答下列问题:
(1)反应①发生的条件是 ;(2)C的化学式是 ;
(3)反应②的化学方程式 ;
(4)图中的转化至少能发生 个复分解反应。