(一)在温度 和
和 下,卤素X2(g)和H2反应生成HX的平衡常数如下表:
下,卤素X2(g)和H2反应生成HX的平衡常数如下表:
| 化学方程式 |
K(t1) |
K(t2) |
F2+H2 2HF 2HF |
1.8×1036 |
1.9×1032 |
Cl2+H2 2HCl 2HCl |
9.7×1012 |
4.2×1011 |
Br2+H2 2HBr 2HBr |
5.6×107 |
9.3×106 |
I2+H2 2HI 2HI |
43 |
34 |
(1)已知t2>t1,生成HX的反应是 反应(填“吸热”或“放热”)。
(2)用电子式表示HCl的形成过程 。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是 (用化学式表示)。
(4)K的变化体现出X2化学性质的递变性,用原子结构解释原因是 。
(二)下图表示一些晶体结构,它们分别是晶体干冰、金刚石、氯化铯、氯化钠某一种的某一部分。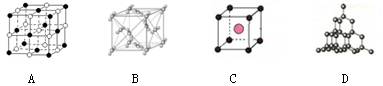
(5)代表金刚石的是 (选填字母);晶体中碳原子与C—C键数目之比是 。
(6)上述B、C、D三种物质熔点由高到低的排列顺序为 (用字母表示)。
(7)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO FeO(填“<,>或=”)。
 d.
d.
 N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下: 浓度
浓度 O2(g)===CO2(g)+2H2O(l) ΔH=-764.6kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.6kJ·mol-1 O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1 CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1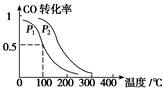


 粤公网安备 44130202000953号
粤公网安备 44130202000953号