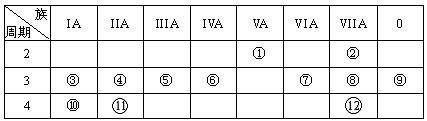
(1)下列ΔH表示物质燃烧热的是 ;表示反应中和热ΔH="-" 57.3 kJ·mol-1的是 。(填“ΔH1”、“ΔH2”和“ΔH3”等)
| A.C(s)+1/2O2(g) = CO(g)ΔH1 |
| B.2H2(g)+O2(g) = 2H2O(l)ΔH2 |
| C.C(s)+O2(g)= CO2(g)ΔH3 |
D. Ba(OH)2(aq)+ Ba(OH)2(aq)+ H2SO4(aq) = H2SO4(aq) =  BaSO4(s)+H2O(l)ΔH4 BaSO4(s)+H2O(l)ΔH4 |
E.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) ΔH5
F.2NaOH(aq)+H2SO4(aq) = Na2SO4(aq)+2H2O(l) ΔH6
(2)在25℃、101kPa下,16.0g甲醇燃烧生成CO2和液态水时放热363.0kJ。则表示甲醇燃烧热的热化学方程式为 。
(3)化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单理解为断开1mol化学键时所需吸收的能量),下表是部分化学键的键能数据:
| 化学键 |
P—P |
P—O |
O==O |
P==O |
| 键能kJ/mol |
a |
360 |
500 |
434 |

已知白磷(P4)的燃烧热为2378kJ/mol,白磷完全燃烧的产物(P4O10)的结构如上图所示,则上表中a= (保留到整数)。
 C+D↑ (2)C+C
C+D↑ (2)C+C A+E (3)D+E
A+E (3)D+E B+C
B+C 粤公网安备 44130202000953号
粤公网安备 44130202000953号