研究NO2、SO2 等大气污染气体的处理具有重要意义。
(1)铜与浓硝酸反应生成NO2的化学反应方程式是 。
(2)NO2可用水吸收,该反应的化学反应方程式是 。
(3)工业上可将SO2通入浓的Fe2(SO4)3溶液中来治理污染得副产物绿矾和硫酸,写出该反应的离子方程式 。
(4)利用反应6NO2 + 8NH3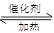 7N2 + 12H2O也可处理NO2。当反应转移0.6mol电子时,则消耗的NH3在标准状况下的体积是 L。
7N2 + 12H2O也可处理NO2。当反应转移0.6mol电子时,则消耗的NH3在标准状况下的体积是 L。
(5)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1=" -" 196.6 kJ·mol-1
2SO3(g) ΔH1=" -" 196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH2=" -" 113.0 kJ·mol-1
2NO2(g) ΔH2=" -" 113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的
SO3(g)+NO(g)的
ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以物质的量之比1∶2置于恒容密闭容器中发生上述反应。
①下列能说明反应达到平衡状态的是( )。
| A.体系压强保持不变 | B.SO3和NO的体积比保持不变 |
| C.混合气体颜色保持不变 | D.每消耗1 mol SO3的同时消耗1 mol NO2 |
②测得上述反应平衡时NO2与SO2物质的量之比为1∶11,该反应的平衡常数K = (保留1位小数)。
 检验溶液中SO42-是否除尽?。如果还有,应该如何除去SO42-离子?。
检验溶液中SO42-是否除尽?。如果还有,应该如何除去SO42-离子?。
 。
。 粤公网安备 44130202000953号
粤公网安备 44130202000953号