(1)能源是现代社会发展的支柱之一。化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是___________(填序号)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌
b.高温煅烧石灰石
c.铝与盐酸反应
(2)某同学进行如下图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是__________(填“吸热”或“放热”)反应,其离子方程式是______________。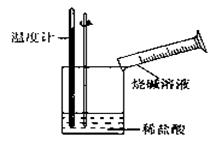
(1)能源是现代社会发展的支柱之一。化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是___________(填序号)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌
b.高温煅烧石灰石
c.铝与盐酸反应
(2)某同学进行如下图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是__________(填“吸热”或“放热”)反应,其离子方程式是______________。