某研究性学习小组,利用固体Na2SO3与中等浓度的H2SO4反应,制备SO2气体并进行有关性质探究实验。该反应的化学方程式为:Na2SO3(固)+H2SO4=Na2SO4 + SO2↑+H2O。除固体Na2SO3和中等浓度的H2SO4外,可供选择的试剂还有:
①溴水 ②浓H2SO4 ③品红试液 ④紫色石蕊试液 ⑤澄清石灰水 ⑥NaOH溶液
回答下列问题:
(1)欲验证SO2的漂白作用,应将SO2气体通入 中(填物质编号),观察到的现象是 ;
(2)欲验证SO2的还原性,应将SO2气体通入 中(填物质编号),观察到的现象是 ;
(3)为说明SO2的氧化性,通常利用的反应是 (写化学反应方程式);
(4)为防止多余的SO2气体污染环境,应将尾气通入 中(填物质编号),
反应离子方程式为 ;
(5)有一实验小组发现,SO2产生缓慢(不考虑SO2在溶液中的溶解,实验中也不存在漏气、反应温度等装置和操作上的问题),请你推测可能的原因(至少填写一种):
① ,② 。
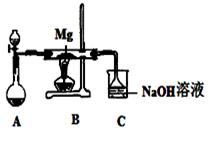
 2MgSO3+S;
2MgSO3+S; 2MgO+MgS;
2MgO+MgS;


 粤公网安备 44130202000953号
粤公网安备 44130202000953号