孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如下图。
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示。回答下列问题:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| PH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀 |
3.2 |
9.0 |
6.7 |
(1)孔雀石研磨的目的是 。
(2)孔雀石的主要成分与足量稀硫酸反应的化学方程式为 。
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用 (填选项序号)。
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离。则pH的范围为 。
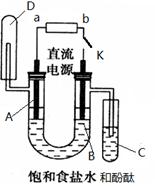
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是 (填代号及对应物质的化学式)。
(6)由溶液C获得CuCl2·3H2O,需要经过 、 、过滤等操作。
(7)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O Cu(OH)2+2H+反应平衡常数 。
Cu(OH)2+2H+反应平衡常数 。
 据此判断:
据此判断:
 丙”转化的离子方程式:。
丙”转化的离子方程式:。 乙”转化的离子方程式:。.
乙”转化的离子方程式:。.
 受热分解的化学方程式是。
受热分解的化学方程式是。 粤公网安备 44130202000953号
粤公网安备 44130202000953号