按下图装置进行实验,并回答下列问题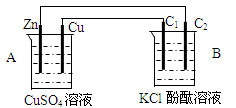
(1)判断装置的名称:A池为 B池为
(2)铜极为______极,电极反应式为
(3)B装置中,C1与C2均为石墨棒,石墨棒C1为___极,电极反应式为 ,石墨棒C2附近发生的实验现象为
(4)当C2极析出224mL(标准状态)气体时,锌的质量减少 g.
按下图装置进行实验,并回答下列问题
(1)判断装置的名称:A池为 B池为
(2)铜极为______极,电极反应式为
(3)B装置中,C1与C2均为石墨棒,石墨棒C1为___极,电极反应式为 ,石墨棒C2附近发生的实验现象为
(4)当C2极析出224mL(标准状态)气体时,锌的质量减少 g.