某研究性学习小组设计了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的 实验方案.请回答下列问题:
小资料:碱石灰的主要成分是氢氧化钠和氧化钙的混合物
(1)气体法。
【原理思路】利用Na2CO3与稀硫酸反应产生CO2,通过测量丙装置实验前后的质量得出CO2质量,从而计算碳酸钠的质量分数。(不考虑原装置内空气的影响)
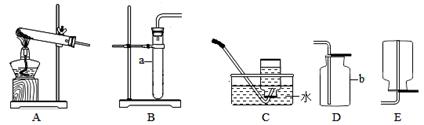
【实验分析】小科同学根据以上思路,设计了如图实验装置。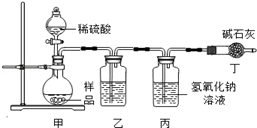
①实验装置乙中盛放的试剂为 ,其作用是 ;
装置丁中碱石灰的作用是 。(填字母)
A.吸收Na2CO3与稀硫酸反应产生CO2
B.防止外界空气中二氧化碳进入丙中
C.干燥二氧化碳
②实验中如果滴加稀硫酸的速度过快,会导致测得样品中碳酸钠的质量分数 (填写“偏高”、“偏低”或“不变”).
③小明同学认为小科的方案存在问题,不考虑原装置内空气的影响,即使操作规范,但由于生成的CO2在装置中残留,也会造成测得结果 (填写“偏高”、“偏低”或“不变”),应该将装置甲中双孔橡胶塞换成三孔橡胶塞,并增加下图装置,实验结束后缓缓通入一段时间空气,目的是 ,其中图中NaOH溶液的作用是 。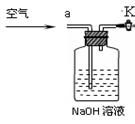
(2)沉淀法.
【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数。
【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;
②加入过量的CaCl2溶液充分反应。证明CaCl2过量(即让样品中Na2CO3完全反应)的方法是:静置,向上层清液中滴加 溶液,如果没有白色沉淀生成,证明CaCl2过量;
③过滤、洗涤、干燥、称量沉淀的质量为10.0g,由于沉淀表面粘附滤液,不经洗涤就烘干,称量沉淀的质量将会 (填写“偏高”、“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数。(写出计算过程,结果保留至0.1%,共3分,只写出化学方程式给1分)



 粤公网安备 44130202000953号
粤公网安备 44130202000953号