在①CH2=CH2 ②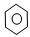 ③CH3CH2OH ④CH3COOH ⑤聚乙烯 五种物质中:
③CH3CH2OH ④CH3COOH ⑤聚乙烯 五种物质中:
(1)属于高分子化合物的是 ;(请填物质的序号,下同。);
(2)能使Br2的CCl4溶液褪色的是 ;
(3)既能发生取代反应又能发生加成反应的是 ;
(4)能与Na2CO3溶液反应的是 ;
(5)能发生酯化反应的是 ;
在①CH2=CH2 ② ③CH3CH2OH ④CH3COOH ⑤聚乙烯 五种物质中:
③CH3CH2OH ④CH3COOH ⑤聚乙烯 五种物质中:
(1)属于高分子化合物的是 ;(请填物质的序号,下同。);
(2)能使Br2的CCl4溶液褪色的是 ;
(3)既能发生取代反应又能发生加成反应的是 ;
(4)能与Na2CO3溶液反应的是 ;
(5)能发生酯化反应的是 ;