现有A、B、C三种烃,其球棍模型如下图: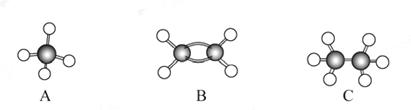
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是_____(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是_____;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____,生成水最多的是_____。
(4)在120 ℃、1.01×105Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是_____。
现有A、B、C三种烃,其球棍模型如下图:
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是_____(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是_____;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____,生成水最多的是_____。
(4)在120 ℃、1.01×105Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是_____。