(每空2分,共10分)有A、B、C三种有机物,结构简式如下图所示,试回答有关问题:
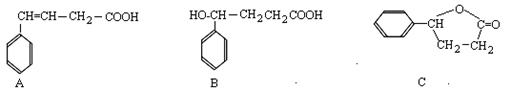
(1)A与C的关系为 。
(2)A→B的反应类型为 。
(3)B→C的化学方程式为 。
(4)1mol A与足量H2发生反应,最多消耗 mol H2;A经加聚反应所得聚合物的结构简式为 。
(每空2分,共10分)有A、B、C三种有机物,结构简式如下图所示,试回答有关问题:

(1)A与C的关系为 。
(2)A→B的反应类型为 。
(3)B→C的化学方程式为 。
(4)1mol A与足量H2发生反应,最多消耗 mol H2;A经加聚反应所得聚合物的结构简式为 。