(8分)用下面的原子或离子结构示意图的编号(A、B、C、D)填空:
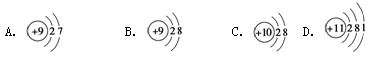
(1)核外电子层排布相同的是__________和___________;
(2)属于同种元素的是__________和__________;
(3)属于金属元素的是____________________;
(4)写出D参加化学反应后所得离子的结构示意图___ ____。
(8分)用下面的原子或离子结构示意图的编号(A、B、C、D)填空:

(1)核外电子层排布相同的是__________和___________;
(2)属于同种元素的是__________和__________;
(3)属于金属元素的是____________________;
(4)写出D参加化学反应后所得离子的结构示意图___ ____。