【选做】【化学—物质结构与性质】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E原子失去3个电子形成的离子核外有5个未成对电子,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)。
(1)写出E基态原子的电子排布式 。
(2)A、B、C的第一电离能由小到大的顺序为 ,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高的原因是 。
(3)B的氢化物的分子空间构型是 ;AC32-的中心原子采取 杂化。
(4)写出任意一种由两种元素组成的与DC2中的阴离子互为等电子体的微粒的化学式 。
(5)E的高价态离子和低价态离子均能与A、B两元素按原子个数比1:1形成带一个单位负电荷的阴离子组成六配位的配离子,写出该配离子的化学式 任写一种)。
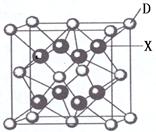
(6)X是周期表中电负性最大的元素,该元素与D元素组成的离子化合物的晶胞如图所示。该离子化合物的化学式为 。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号