以下是氮循环的一部分: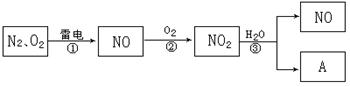
(1)通常状况下,NO2的颜色是 ;
(2)反应①的化学方程式是 ;
(3)NO2易溶于水,并和水发生化学反应。该反应中,氧化剂是 ;
(4)化合物A的化学式是 ;
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:
2NO + 2CO = 2CO2 + N2。当生成2mol N2时,被还原的NO为 mol。
以下是氮循环的一部分:
(1)通常状况下,NO2的颜色是 ;
(2)反应①的化学方程式是 ;
(3)NO2易溶于水,并和水发生化学反应。该反应中,氧化剂是 ;
(4)化合物A的化学式是 ;
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:
2NO + 2CO = 2CO2 + N2。当生成2mol N2时,被还原的NO为 mol。