锂被誉为“高能金属”。工业上用硫酸与β-锂辉矿(LiAlSi2O6和少量钙镁杂质)在250~300℃反应,生成Li2SO4以及硅铝化合物、MgSO4等,其工业生产流程如下: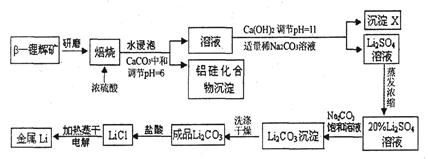
(1)用氧化物形式表示LiAlSi2O6的组成:___________________。
(2)沉淀X的主要成分是(写化学式)________________________。
(3)流程中两次使用了N a2CO3溶液,试说明前后浓度不同的原因:
a2CO3溶液,试说明前后浓度不同的原因:
____________________________________________________________________。
(4)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体。试写出氢化锂遇水反应的化学方程式:_____________________________________。
(5)将盐酸与Li2C03完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是__________________________________________。
 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O

 粤公网安备 44130202000953号
粤公网安备 44130202000953号