氮元素在地球上丰度较大,氮及其化合物用途广泛。请回答:
(1)下图是氮气和氢气反应生成1mol氨气的能量变化示意图,写出上述反应的热化学方程式: 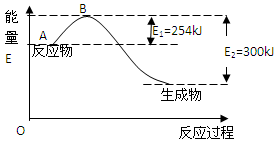
(2)已知下列数据:
| 化学键 |
H—H |
N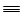 N N |
| 键能/( kJ/mol) |
435 |
943 |
根据表中和图中数据,计算N-H的键能为: kJ/mol
(3)用氨催化还原NOx(氮氧化物),可消除污染。
已知:4NH3(g)+3O2(g) =2N2(g)+6H2O(g) △H1 =" –a" kJ/mol
N2(g)+O2(g)=2NO(g) △H2 =" –b" kJ/mol
则反应:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)的反应热△H= kJ/mol(用含a和b的代数式表示)其中氧化剂是 ,还原剂是 (均填分子式)


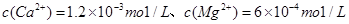 、
、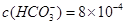
 。要软化10 m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3g。
。要软化10 m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3g。 2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。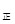 v
v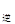 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。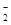 ,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____。
,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____。 ,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为(用含a的代数式表示)。
,若在上述条件下,把l000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为(用含a的代数式表示)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号