请结合下列常用的仪器和装置,回答相关问题: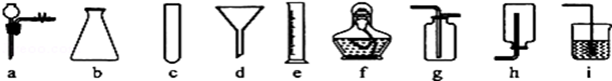
(1)写出仪器的名称:c f
(2)能用来量取一定体积液体的仪器是 (填序号)
(3)下列有关连接仪器方法的描述中,错误的是: (填序号)。
| A.将乳胶管一端塞进玻璃导管内 |
| B.玻璃导管口一端旋进乳胶管一端 |
| C.将单孔橡胶塞的约二分之一旋进试管口 |
| D.乳胶管与玻璃导管连接前把乳胶管用水润湿管口 |
请结合下列常用的仪器和装置,回答相关问题:
(1)写出仪器的名称:c f
(2)能用来量取一定体积液体的仪器是 (填序号)
(3)下列有关连接仪器方法的描述中,错误的是: (填序号)。
| A.将乳胶管一端塞进玻璃导管内 |
| B.玻璃导管口一端旋进乳胶管一端 |
| C.将单孔橡胶塞的约二分之一旋进试管口 |
| D.乳胶管与玻璃导管连接前把乳胶管用水润湿管口 |