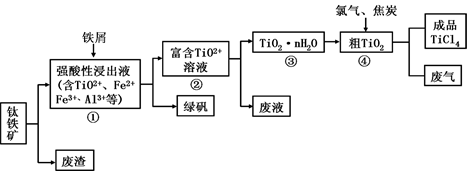
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。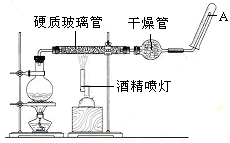
(1)写出该反应的化学方程式 ,其中氧化剂是 ,还原剂是 。8.4g铁粉参加反应,转移电子 mol。
(2)玻璃管中石棉绒的作用是 ,实验开始时应先点燃 ,实验结束时应先熄灭 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶里应事先放置 ,其作用是 。
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是 ,若溶液未变红色则说明硬质试管中固体物质的成分是 。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是 (用离子方程式表示)。
(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式 , 。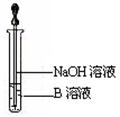
(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是 ,并且配制含Fe2+的盐溶液时应加入少量 。
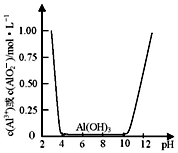
 Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。 2CO(g) △H=-221kJ·mol-1
2CO(g) △H=-221kJ·mol-1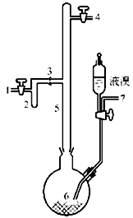
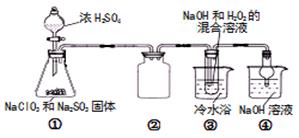
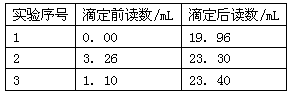
 粤公网安备 44130202000953号
粤公网安备 44130202000953号