甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为: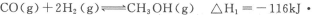
(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是_____。
a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.增大体系压强
d.使用高效催化剂
(2)已知: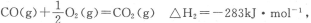
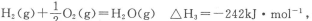
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___________________.
(3)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系。请回答: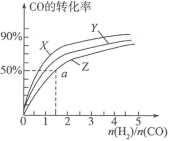
①在图中三条曲线,对应的温度由高到低的顺序是__________________;
②利用a点对应的数据,计算出曲线Z在对应温度下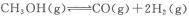 的平衡常数:K=______;
的平衡常数:K=______;
(4)恒温下,分别将1 molCO和2molH2置于恒容容器I和恒压容器Ⅱ中(两容器起始容积相同),充分反应。
①达到平衡所需时间是I _____Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中CH3OH的体积分数关系是I_____Ⅱ。
②平衡时,测得容器工中的压强减小了30%,则该容器中CO的转化率为______。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号