(15分)三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到。
已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解。实验室制取PCl3的装置示意图和有关数据如下: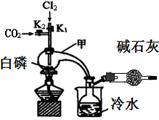
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
| 白磷 |
44.1 |
280.5 |
1.82 |
| PCl3 |
-112 |
75.5 |
1.574 |
| POCl3 |
2 |
105.3 |
1.675 |
请回答:
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有 。制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥
的 (写出操作、现象、结论)。
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是 。
(3)E烧杯中加入冷水的目的是 ,干燥管中碱石灰的作用是 。
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有 (填字母序号)。
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是 (已知亚磷酸(H3PO3)是二元弱酸)。
②若将0.01 mol POCl3投入热水配成1 L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是 [已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
 ①加热时放出的气体可以使品红溶液褪色;
①加热时放出的气体可以使品红溶液褪色;







 (1)向品红溶液中通过量SO2的过程中的现象为__________;加热后的现象为_______。
(1)向品红溶液中通过量SO2的过程中的现象为__________;加热后的现象为_______。 氧化成
氧化成 ,而稀硝酸不能氧化
,而稀硝酸不能氧化


 粤公网安备 44130202000953号
粤公网安备 44130202000953号