研究表面,可用NaBH4与水反应制氢氧燃料电池的氢气:BH4-+2H2O=BO2-+4H2↑(实质为水电离产生的H+被还原)。下表为pH和温度对本反应中NaBH4半衰期的影响(半衰期是指反应过程中,NaBH4的浓度降低到初始浓度一半时所需的时间)。
| 体系 pH |
不同温度下NaBH4的半衰期(min) |
|||
| 0℃ |
25℃ |
50℃ |
75℃ |
|
| 8 |
4. 32 ×100 |
6. 19 ×10-1 |
8. 64 ×10-2 |
1.22 ×10-2 |
| 10 |
4. 32 ×102 |
6. 19 ×101 |
8. 64 ×100 |
1.22 ×100 |
| 12 |
4. 32 ×104 |
6. 19 ×103 |
8. 64 ×102 |
1.22 ×102 |
| 14 |
4. 32 ×106 |
6. 19 ×105 |
8. 64 ×104 |
1.22 ×104 |
根据要求回答下列问题:
(1)NaBH4与水反应后所得溶液显碱性,则溶液中各离子浓度大小关系为___________。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响?
答: 。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响?
答: 。
(4)实验表明,将NaBH4溶于足量水,释放的H2比理论产量少得多(即反应一段时间后有NaBH4剩余也不再反应)。其可能原因是 。

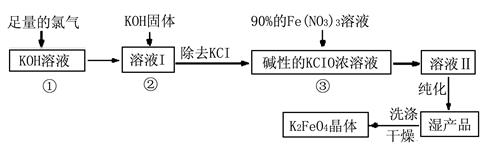
 3Zn+2K2FeO4+8H2O,
3Zn+2K2FeO4+8H2O,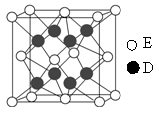
 粤公网安备 44130202000953号
粤公网安备 44130202000953号