以下是某实验小组用工业硫酸铜(含硫酸亚铁等杂质)进行提纯实验,得到纯净硫酸铜晶体的流程:(已知数据:lg2=0.3;lg5=0.7)
请回答下列问题:
(1)①步骤I的目的是除不溶性杂质。操作是 。
②步骤Ⅱ是为了除去Fe2+,常加入氧化剂使Fe2+氧化为Fe3+,下列物质最适合的是________。
A.KMnO4 B.H2O2 C.Cl2水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A.NaOH B.NH3·H2O C.CuO D.Cu
(2)已知常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,分别写出Cu(OH)2开始沉淀时溶液的pH=________并写出步骤Ⅱ调节溶液pH的合理范围______。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.3
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。

 4CO(g) + BaS(s) △H1 =" 571.2" kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =" 571.2" kJ·mol-1 ① = 。
= 。
 =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。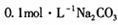 溶液中,所含的离子按物质的量浓度由大到小的顺序排列为 。
溶液中,所含的离子按物质的量浓度由大到小的顺序排列为 。