铁的单质和化合物在实验和实际生产中都有重要作用。
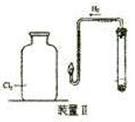
Ⅰ.某同学将Cl2通入FeCl2和KSCN混合溶液中,现象为:
| 操作 |
现象 |
 |
现象1:A中溶液变红 现象2:稍后,溶液由红色变为黄色 |
(1)B装置中反应的化学方程式____________ _ _______________ _______。
(2)A中溶液变红的原因是____________________ _ _________________________。
(3)为探究产生现象2的原因,该同学进行如下实验:
①取少量A中黄色溶液于试管加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_ _。
②取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液。
实验说明,Fe3+与SCN-生成红色Fe(SCN) 3的反应 可逆反应(是或不是)。
(4)该同学根据实验猜想,SCN-可能被氯水氧化。查资料得知SCN-的电子式为 ,
,
离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H+ + CO2 ;
①上述反应中,0.5molSCN-被氧化时转移的电子总数为 个。
②若要检验产物中含有SO42-,常用的化学试剂是________(写试剂名称)。
Ⅱ.高铁电池因原料丰富、绿色环保而倍受关注。Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,该极电极为______极,电极反应式为________________ __。





 溶液体积/mL
溶液体积/mL
 粤公网安备 44130202000953号
粤公网安备 44130202000953号