(6分)完成下列反应的化学方程式或要求:
(1)写出电解饱和食盐水制氯气的化学反应方程式: 。
(2)写出电解熔融氯化镁制取金属镁的化学反应方程式: 。
(3)用双线桥标出下述反应中电子转移的方向和数目 C + 4HNO3(浓)
C + 4HNO3(浓) 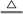 CO2↑ + 4NO2↑+2H2O
CO2↑ + 4NO2↑+2H2O
(6分)完成下列反应的化学方程式或要求:
(1)写出电解饱和食盐水制氯气的化学反应方程式: 。
(2)写出电解熔融氯化镁制取金属镁的化学反应方程式: 。
(3)用双线桥标出下述反应中电子转移的方向和数目 C + 4HNO3(浓)
C + 4HNO3(浓) 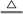 CO2↑ + 4NO2↑+2H2O
CO2↑ + 4NO2↑+2H2O