弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是 (用离子方程式表示)。
(2)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式: 。
(3)0.1mol/L的NaHA溶液中,测得溶液中的显碱性。则
①该溶液中c(H2A) c(A2-)(填“>”、“<”或“=”)。
②作出上述判断的依据是 (用文字解释)。
(4)含Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
①绿矾为FeSO4·7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为 。
②常温下若处理后的废水中c(Cr3+)=6.0×10-7 mol·L-1,则处理后的废水的pH=______。(Ksp[Cr(OH) 3]=6.0×10-31)
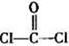 )分子中含有______个
)分子中含有______个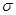 键,____个
键,____个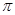 键,其中C原子的杂化方式为_______。
键,其中C原子的杂化方式为_______。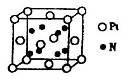 所示,则氮化铂的化学式为_______。
所示,则氮化铂的化学式为_______。 粤公网安备 44130202000953号
粤公网安备 44130202000953号