大麻酚及它的衍生物都属麻醉药品,并且毒性较强。吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中。吸食大麻还可破坏男女的生育能力,而且由于大麻中焦油含量高,其致癌率也较高。大麻酚分子结构为
回答下列问题: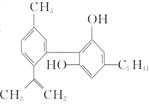
(1)大麻酚的分子式为__________。
(2)写出大麻酚燃烧的化学方程式:______________________________________________。
(3)大麻酚属酚类化合物,写出大麻酚与NaOH及足量溴水的反应产物__________。
大麻酚及它的衍生物都属麻醉药品,并且毒性较强。吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中。吸食大麻还可破坏男女的生育能力,而且由于大麻中焦油含量高,其致癌率也较高。大麻酚分子结构为
回答下列问题:
(1)大麻酚的分子式为__________。
(2)写出大麻酚燃烧的化学方程式:______________________________________________。
(3)大麻酚属酚类化合物,写出大麻酚与NaOH及足量溴水的反应产物__________。