(选考)[选修3—物质结构与性质](15分)
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与P能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有_________种不同运动状态的电子,T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为_____________
(4)Z与R能形成化合物甲,1 mol甲中含________mol化学键,甲与氢氟酸反应,生成 物的分子空间构型分别为________________________
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为________________。
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为____________。
(7)X单质的晶胞如图所示,一个X晶胞中有________________个X原子。若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为________cm(用代数式表示)
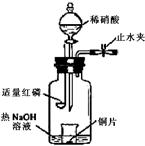





 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
 (3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是。



 过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号