一定温度下,在2L密闭容器中NO2和O2可发生下列反应: 4NO2(g)+O2(g)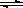 2N2O5(g)+5286 kJ已知体系中n(NO2)随时间变化如下表:
2N2O5(g)+5286 kJ已知体系中n(NO2)随时间变化如下表:
| t(s) |
0 |
500 |
1000 |
1500 |
| n(NO2)(mol) |
20 |
13.96 |
10.08 |
10.08 |
(1)能说明该反应已达到平衡状态的是 。
A.v(NO2)=4v(O2) B.容器内压强保持不变
C.v逆(N2O5)=2v正(O2) D.容器内密度保持不变
(2)反应达到平衡后,NO2的转化率为 ,此 时若再通入一定量氮气,则NO2的转化率将 (填“增大”、“减小”、“不变”)。
(3)图中能表示N2O5的浓度变化的曲线是 ,用O2表示从0~500s内该反应的平均速率v= 。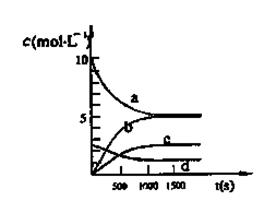
(4)能使该反应的反应速率增大,且平衡向正应方向移动的是 。
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂

 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:

 粤公网安备 44130202000953号
粤公网安备 44130202000953号