[物质结构与性质]元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
4FeCl3+2NH2OH•HCl= 4FeCl2+N2O↑+6HCl+H2O
①Fe3+在基态时,核外电子排布式 ;
②羟胺中(NH2OH)采用sp3杂化的原子有 ,三种元素电负性由大到小的顺序为 ;
③Fe2+与邻啡罗啉(用A表示)形成的配合物[FeA3] 2+中,Fe2+的配位数为 ;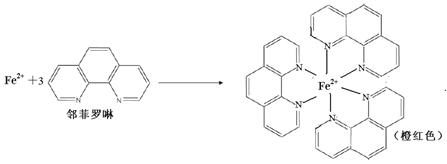
④N2O分子的空间构型为 (用文字描述)。
(2)氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可分解水制取H2同时获得O2。已知钛酸锶晶胞结构如图所示,则钛酸锶的化学式为 。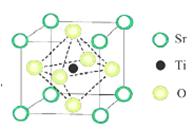
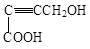 是重要的化工原料,其合成过程如下:
是重要的化工原料,其合成过程如下:
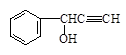 )与
)与 发生反应的方程式为。
发生反应的方程式为。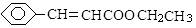 )的路线如下:
)的路线如下: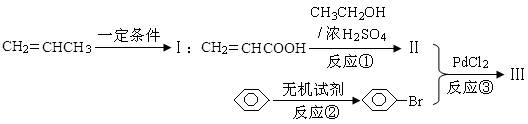

 CO (g) +H2 (g) △H1
CO (g) +H2 (g) △H1
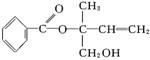
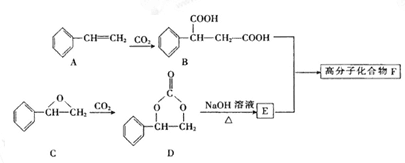
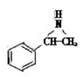 在一定条件下,化合物Ⅲ也能与CO2发生类似于化合物C与CO2反应生成D的反应,生成两种化合物(互为同分异构体),写出其中任意一种化合物的结构简式:。
在一定条件下,化合物Ⅲ也能与CO2发生类似于化合物C与CO2反应生成D的反应,生成两种化合物(互为同分异构体),写出其中任意一种化合物的结构简式:。
 Fe2++
Fe2++  N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的(填“深”或“浅”),原因是。
N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的(填“深”或“浅”),原因是。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号