由单质A与化合物B两种粉末组成的混合物, 在一定条件下可按下图所示发生转化: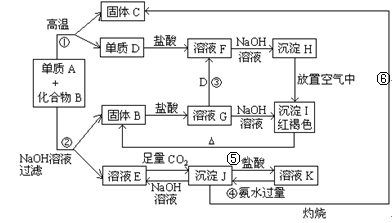
请回答:
(1)A的化学式 ; B的化学式
(2)反应①的化学方程式为
(3)反应②的离子方程式为
(4)检验G中所含金属阳离子常用试剂为: ,用G溶液制备胶体的化学方程式为
由单质A与化合物B两种粉末组成的混合物, 在一定条件下可按下图所示发生转化:
请回答:
(1)A的化学式 ; B的化学式
(2)反应①的化学方程式为
(3)反应②的离子方程式为
(4)检验G中所含金属阳离子常用试剂为: ,用G溶液制备胶体的化学方程式为