运用化学反应原理知识在工业生产中有重要意义。
甲醇是一种可再生能源,具有广泛的开发和应用前景。如甲醇汽油是由10%一25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标。
I、(一)甲醇在工业上可用CO和H2合成。
已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
(二)若要求得CO(g)+2H2(g)=CH3OH(l)的△H,还需要知道反应(用化学方程式表示) 的焓变。
工业上合成甲醇一般采用下列反应:CO(g)+2H2(g) CH3OH(g) △H=akJ/mol
CH3OH(g) △H=akJ/mol
下表是该反应在不同温度下的化学平衡常数(K):
| 温度/0C |
250 |
310 |
350 |
| K |
2.041 |
0.250 |
0.012 |
(1)由表中数据判断△H= a 0(填“>”、“=”或“<”)。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)="0.5" mol·L-1,则此时的温度为 ℃。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 浓度mol/L 时间/min |
c(CO) |
c(H2) |
c(CH3OH) |
| 0 |
0.8 |
1.6 |
0 |
| 2 |
0.6 |
1.2 |
0.2 |
| 4 |
0.3 |
0.6 |
0.5 |
| 6 |
0.3 |
0.6 |
0.5 |
①反应从0 min到4 min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2 min时改变了反应条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2 mol H2,发生反应CO(g)+2 H2(g) CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则w1 w2(填序号)。
CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则w1 w2(填序号)。
A.大于 B.小于 C.等于 D.以上都有可能
II、甲醇在化学电源方面也有着重要应用。写出以甲醇为燃料,氢氧化钠溶液为电解质溶液的原电池中负极的电极反应式: 。
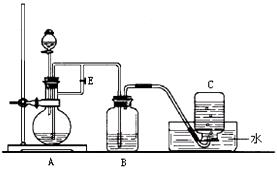
 塞E(填“打开”或“关闭”),目的是
塞E(填“打开”或“关闭”),目的是 。
。
 瓶b中的现象._________________________________.
瓶b中的现象._________________________________. 成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有______________________。
成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有______________________。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号