Ⅰ.在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t(℃)
|
700
|
800
|
830
|
1000
|
1200
|
K
|
0.6
|
0.9
|
1.0
|
1.7
|
2.6
|
请回答下列问题:
(1)该反应为反应(填“吸热”或“放热”)。
(2)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =" 0.01" mol/L,c(H2O) =" 0.03" mol/L,c(CO2) =" 0.01" mol/L,c(H2) =" 0.05" mol/L,则反应开始时,H2O的消耗速率比生成速率 __ _(填“大”、“小”或“不能确定”)。
Ⅱ.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s)
|
0
|
1
|
2
|
3
|
4
|
5
|
c(NO)
(mol/L)
|
1.00×10-3
|
4.50×10-4
|
2.50×10-4
|
1.50×10-4
|
1.00×10-4
|
1.00×10-4
|
c(CO)
(mol/L)
|
3.60×10-3
|
3.05×10-3
|
2.85×10-3
|
2.75×10-3
|
2.70×10-3
|
2.70×10-3
|
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H0(填写“>”、“<”、“=”)。
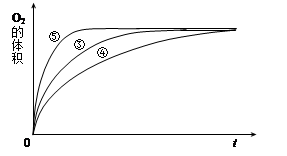
(2)前2s内的平均反应速率v(N2)=。
(3)在该温度下,反应的平衡常数K=。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)若在恒温、恒压条件下向平衡体系中通入氩气,则平衡移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
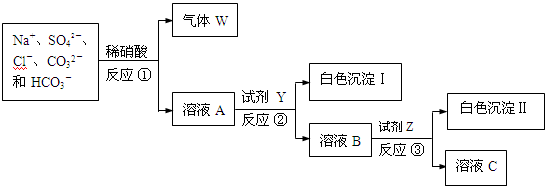
 (1)气体W的化学式是 。
(1)气体W的化学式是 。 溶液A中主要存在的微粒除了Na+、SO42-、Cl-之外还有 。
溶液A中主要存在的微粒除了Na+、SO42-、Cl-之外还有 。 N2O4(g) ΔH=-57 kJ/mol,
N2O4(g) ΔH=-57 kJ/mol,
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表: 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表: Na3AlH6 (s)+
Na3AlH6 (s)+ 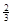 Al (s) + H2(g)ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g)ΔH=+ 37 kJ·molˉ1 H2(g)ΔH=+ 70.5 kJ·molˉ1
H2(g)ΔH=+ 70.5 kJ·molˉ1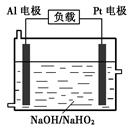

 粤公网安备 44130202000953号
粤公网安备 44130202000953号