A、B、C、D、E是原子序数依次增大的短周期主族元素。A元素可形成多种同素异形体,其中一种是自然界最硬的物质;B的原子半径在短周期主族元素中最大;C原子核外电子占据7个不同的原子轨道;D的单质在常温常压下是淡黄色固体。
(1)E在元素周期表中的位置 ;B的基态原子核外电子排布式为 。
(2)A、D、E中电负性最大的是 (填元素符号);B、C两元素第一电离能较大的是 (填元素符号)。
(3)A和D两元素非金属性较强的是 (填元素符号),写出能证明该结论的一个事实依据 。
(4)化合物AD2分子中共有 个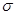 键和___个
键和___个 键,AD2分子的空间构型是 。
键,AD2分子的空间构型是 。
(5)C与E形成的化合物在常温下为白色固体,熔点为190℃,沸点为182.7℃,在177.8℃升华,推测此化合物为 晶体。工业上制取上述无水化合物方法如下:C的氧化物与A、E的单质在高温条件下反应,已知每消耗12kgA的单质,过程中转移2×l03mol e-,写出相应反应的化学方程式: 。
 +4)制取纳米级TiO2的流程如下:
+4)制取纳米级TiO2的流程如下: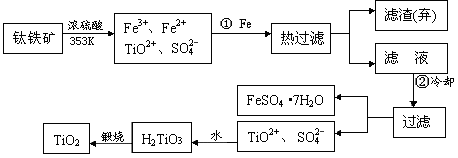
 TiCl4
TiCl4 Ti
Ti 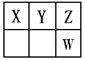
 ,
, CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 。
 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: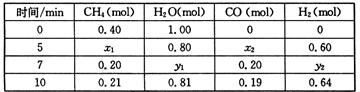

 粤公网安备 44130202000953号
粤公网安备 44130202000953号